Ο βιοκαταλύτης Οξειδάση θειώδους προκαλεί τη μετατροπή τοξικών ενώσεων θείου από τη διάσπαση των αμινοξέων σε μη τοξικά θειικά.
Είναι ζωτικής σημασίας και επομένως εμφανίζεται σε όλους τους οργανισμούς. Εάν η λειτουργία του διαταράσσεται από γενετικό ελάττωμα, εμφανίζεται ανεπάρκεια θειικής οξειδάσης. Πολύ υψηλή περιεκτικότητα σε θειώδη άλατα στο αίμα μπορεί επίσης να έχει αρνητικές επιπτώσεις σε κατά τα άλλα υγιείς ασθενείς.
Τι είναι η θειική οξειδάση;
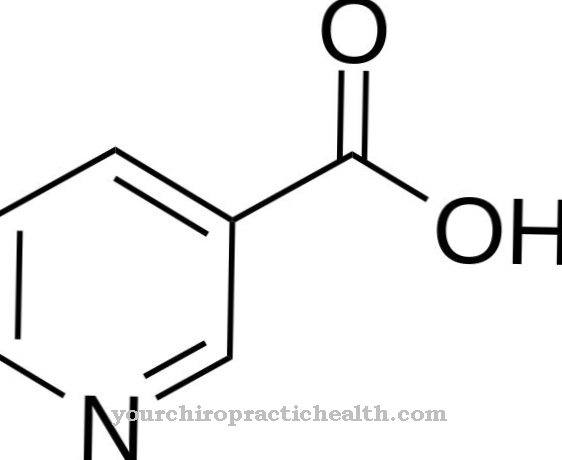
Η θειική οξειδάση (όνομα γονιδίου: SUOX) είναι το όνομα ενός ενζύμου που περιέχει μολυβδαίνιο και αποτελείται από 466 αμινοξέα. Ανήκει στην οικογένεια των αφυδρογονώνων ξανθίνης και εμφανίζεται σε όλους σχεδόν τους οργανισμούς. Περιέχει μολυβδαίνιο, ένα ζωτικό ιχνοστοιχείο, στο κέντρο του.
Το μέταλλο εμφανίζεται εκεί στη βιοδιαθέσιμη μορφή του ως ανιόν μολυβδαινίου. Η θειική οξειδάση τη χρησιμοποιεί ως συμπαράγοντα (ένωση μολυβδαινίου-μολυβδοπτερίνης). Το ένζυμο μετατρέπει τα αμινοξέα που περιέχουν θείο μεθειονίνη, κυστεΐνη κ.λπ., τα οποία προσλαμβάνονται μέσω τροφής, σε ακίνδυνα άλατα θείου (θειικά), τα οποία στη συνέχεια απεκκρίνονται στα ούρα. Στα θηλαστικά, ο βιοκαταλύτης που αποικοδομεί το θείο εμφανίζεται κυρίως στο ήπαρ και στα νεφρά. Το ένζυμο θειώδες οξειδάση διασφαλίζει ότι το οξυγόνο του αίματος συνδυάζεται με τα απαραίτητα αμινοξέα και άλλες ουσίες θείου.
Τα ηλεκτρόνια που απελευθερώνονται στη διαδικασία χρησιμοποιούνται για την παραγωγή ΑΤΡ (τριφωσφορική αδενοσίνη) μέσω της αλυσίδας μεταφοράς ηλεκτρονίων. Το ένζυμο καταλύει 10 φορές την ποσότητα των θειώδων που βρίσκονται σε ένα λίτρο αλκοόλης κάθε μέρα.
Λειτουργία, εφέ & εργασίες
Όλοι καταναλώνουν πρωτεΐνες και πρόσθετα τροφίμων που περιέχουν θείο σε καθημερινή βάση. Τα τελευταία περιέχονται, για παράδειγμα, σε τουρσί λαχανικά, χυμό γκρέιπφρουτ κ.λπ. και προορίζονται να προστατεύσουν τα τρόφιμα από την προσβολή και τον αποχρωματισμό των μικροβίων. Σχηματίζουν ανθοδέσμες στο κρασί.
Μόνο η διάσπαση της κυστεΐνης έχει ως αποτέλεσμα 1680 mg τοξικού θειώδους άλατος στο σώμα κάθε μέρα, το οποίο πρέπει να μετατρέπεται αμέσως από τη θειική οξειδάση έτσι ώστε τα όργανα και οι ιστοί να μην υποστούν βλάβη. Το ένζυμο συνεργάζεται με άλλους βιοκαταλύτες. Τα θειώδη άλατα είναι δηλητηριώδη και μπορούν να καταστρέψουν ζωτικές ουσίες στο σώμα και να αναστέλλουν τις απαραίτητες μεταβολικές διεργασίες ακόμη και στις μικρότερες ποσότητες. Για να είναι σε θέση να πραγματοποιήσει τη σημαντική αποτοξίνωση των κυττάρων, η θειική οξειδάση χρειάζεται το ιχνοστοιχείο μολυβδαίνιο.
Η έλλειψη αυτού του μετάλλου μπορεί να οδηγήσει σε σοβαρές συνέπειες. Πολύ υψηλό επίπεδο υδραργύρου στο σώμα μπορεί επίσης να αναστείλει τη λειτουργικότητα της θειικής οξειδάσης.
Εκπαίδευση, εμφάνιση, ιδιότητες και βέλτιστες τιμές
Η θειική οξειδάση παράγεται κυρίως στα μιτοχόνδρια, τα «ενεργειακά κέντρα» των κυττάρων. Σε αρουραίους, για παράδειγμα, το 80 τοις εκατό εμφανίζεται στα μιτοχόνδρια των ηπατικών κυττάρων. Αντιπροσωπεύεται επίσης έντονα στα κύτταρα των νεφρών.
Το οξείδιο του μολυβδαινίου που απαιτείται για τη δραστικότητα της θειικής οξειδάσης βρίσκεται στο ενεργό κέντρο του ενζύμου. Όπως ανακάλυψαν πρόσφατα οι επιστήμονες, τα νανοσωματίδια τριοξειδίου του μολυβδαινίου μπορούν να το αντικαταστήσουν σε ασθενείς με ανεπάρκεια μολυβδαινίου. Έχουν παρόμοια καταλυτική επίδραση στο σώμα με το φυσικό ένζυμο. Με αυτόν τον τρόπο, στο παρελθόν θανατηφόρες ασθένειες όπως η σουλφοκυστεϊνουρία θα μπορούσαν να αντιμετωπιστούν.
Ασθένειες & Διαταραχές
Η ανεπάρκεια της θειώδους οξειδάσης μπορεί να προκαλέσει ασθματικές και ακόμη και αναφυλακτικές αντιδράσεις σε κατά τα άλλα υγιείς ανθρώπους, καθώς το παρασυμπαθητικό νευρικό σύστημα επηρεάζει τα ιστιοκύτταρα που είναι υπεύθυνα για την ανάπτυξη αλλεργιών.
Επιπλέον, εάν το επίπεδο της θειώδους οξειδάσης είναι πολύ χαμηλό, μπορεί να οδηγήσει σε σοβαρή κόπωση, πονοκεφάλους και χαμηλά επίπεδα σακχάρου στο αίμα. Η γενετική ανεπάρκεια στο ζωτικό ένζυμο έχει ακόμη χειρότερες συνέπειες. Το νεογέννητο γεννιέται με σωματικές παραμορφώσεις και ψυχικές αναπηρίες. Αυτή η αποκαλούμενη ανεπάρκεια θειικής οξειδάσης ή σουλφοκυστεϊνουρία εμφανίζεται ως ασθένεια ανεπάρκειας συμπαράγοντα μολυβδαινίου (MoCo) σε περίπου 100.000 έως 500.000 γεννήσεις. Τα βρέφη που πάσχουν από ένα ελάττωμα μεμονωμένης θειώδους οξειδάσης παρουσιάζουν παρόμοια συμπτώματα: σοβαρή εγκεφαλοπάθεια, μόλις ελεγχόμενες επιληπτικές κρίσεις, σπαστικότητα, μικροκεφαλία, μυϊκή χαλάρωση και προοδευτική ατροφία του εγκεφάλου.
Δεδομένου ότι η αυτοσωματική υπολειπόμενη κληρονομική ενζυμική ανεπάρκεια ασθένεια δεν μπορεί προς το παρόν να αντιμετωπιστεί αποτελεσματικά, οι μικροί ασθενείς συνήθως πεθαίνουν στην παιδική ηλικία: Οι θειικές ενώσεις που δεν διασπώνται δηλητηριώδεις νευρώνες και θήκες μυελίνης του κεντρικού νευρικού συστήματος και συσσωρεύονται στον κυτταρικό ιστό. Ήδη μετά τη γέννηση υπάρχουν προβλήματα με το φαγητό και τον εμετό του περιεχομένου του στομάχου. Τα βρέφη γεννιούνται με ένα παραμορφωμένο κρανίο (προεξέχον μέτωπο, βαθιά μάτια, υπερβολικά μακριά βλέφαρα, χοντρά χείλη, μικρή μύτη). Κατά τους πρώτους μήνες της ζωής, ο φακός μετατοπίζεται στο μάτι.
Περίπου το 75 τοις εκατό των περιπτώσεων σουλφοκυστεϊνουρίας που περιγράφονται μέχρι στιγμής προκαλούνται από ανεπάρκεια MoCo: Και τα τρία ένζυμα που εμπλέκονται στη διάσπαση του θείου στο σώμα, η θειική οξειδάση, η οξειδάση της ξανθίνης και η οξειδάση της αλδεϋδης, εμφανίζουν πολύ μειωμένη δραστηριότητα. Ο λόγος για την απομονωμένη ανεπάρκεια θειικής οξειδάσης είναι μια μετάλλαξη στο γονίδιο SUOX (χρωμόσωμα 12). Εμφανίζεται σε τρεις παραλλαγές: τύπος Α (μετάλλαξη στο γονίδιο MOCS1), τύπος Β (γονίδιο MOCS2) και τύπος C (γονίδιο MOCS3). Η μετάλλαξη τύπου Α είναι η πιο κοινή. Ο σχηματισμός του προδρόμου μορίου cPMP αναστέλλεται. Ωστόσο, η ουσία μπορεί τώρα να παρασκευαστεί και να χορηγηθεί στο εργαστήριο.Προκειμένου να βελτιωθεί ο χρόνος επιβίωσης του παιδικού ασθενούς, η ασθένεια ανεπάρκειας θα πρέπει να διαγνωστεί το συντομότερο δυνατό και να αντιμετωπιστεί με καθημερινές ενδοφλέβιες χορηγήσεις μολυβδάτης.
Με αυτόν τον τρόπο, μπορεί να περιοριστεί τουλάχιστον περαιτέρω ζημιά. Το παιδί λαμβάνει αντισπασμωδικό φάρμακο για την καταπολέμηση των επιληπτικών κρίσεων. Πρέπει επίσης να ακολουθούν δίαιτα χαμηλής περιεκτικότητας σε πρωτεΐνες. Εναλλακτικά, μπορεί να χορηγηθεί και ο πρόδρομος MoCo Z. Μειώνει τις επιληπτικές κρίσεις και αποτρέπει περαιτέρω εγκεφαλική βλάβη. Η ιατρική έχει μεγάλες ελπίδες για τη θεραπεία της προηγουμένως ανίατης ασθένειας με νανοσωματίδια τριοξειδίου του μολυβδαινίου, τα οποία αναλαμβάνουν το ρόλο της θειικής οξειδάσης στο σώμα. Για να μάθετε εάν το αγέννητο παιδί έχει ανεπάρκεια θειικής οξειδάσης, η έγκυος μπορεί να ελέγξει το επίπεδο της S-σουλφοκυστεΐνης στο αμνιακό υγρό.





.jpg)



.jpg)
.jpg)