Δεσμοσίνη είναι ένα πρωτεϊνογενές αμινοξύ. Μαζί με άλλα αμινοξέα, σχηματίζει την ίνα και τη δομική πρωτεΐνη ελαστίνη. Με μεταλλάξεις στο γονίδιο ELN, διαταράσσεται η δομή της ελαστίνης.
Τι είναι η δεσμοσίνη;
Τα αμινοξέα είναι ένα σημαντικό μέρος του ανθρώπινου οργανισμού. Είναι μια κατηγορία οργανικών ενώσεων που σχηματίζονται από τουλάχιστον μία καρβοξυ ομάδα και μία αμινομάδα. Τα αμινοξέα είναι επομένως τόσο καρβοξυλικά οξέα όσο και αμίνες.
Ανάλογα με τη θέση τους σε σχέση με την καρβοξυ ομάδα, τα αμινοξέα μπορούν να αποδοθούν σε διαφορετικές ομάδες. Τα αμινοξέα με μια τελική καρβοξυ ομάδα ονομάζονται geminal ή α και υπολογίζονται μεταξύ των α-αμινοξέων. Αυτά τα αμινοξέα είναι στοιχεία πρωτεϊνών. Το ανθρώπινο σώμα έχει περισσότερα από 20 πρωτεϊνογενή αμινοξέα και 400 μη πρωτεϊνογενή αμινοξέα. Τα D-αμινοξέα είναι μια ειδική ομάδα. Ένα από τα περισσότερα από 20 πρωτεϊνογενή αμινοξέα είναι η δεσμοσίνη, η οποία μαζί με την παρόμοια δομημένη ισοσοσμοσίνη σχηματίζει την πρωτεΐνη ινών ελαστίνη.
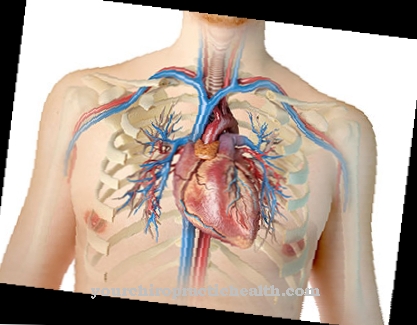
Η ελαστίνη και ο διαλυτός πρόδρομος της τροποελαστίνης ανήκουν στις δομικές πρωτεΐνες και συμβάλλουν στη διαμόρφωση και διατήρηση ανατομικών δομών. Η ελαστίνη παίζει ιδιαίτερο ρόλο στην ικανότητα των μεγάλων αιμοφόρων αγγείων να τεντώνουν, για παράδειγμα την αορτή.
Λειτουργία, εφέ & εργασίες
Η δεσμοσίνη είναι τυπικά ένα τετραπλό αμινοξύ. Διαθέτει δακτύλιο πυριδινίου στο κέντρο. Η πυριδίνη είναι μια χημική ένωση με τον εμπειρικό τύπο C5H5N, η οποία μπορεί να αποδοθεί στα ετεροκυκλικά μητρικά συστήματα και σχηματίζει την απλούστερη αζίνη με τη μορφή ενός εξαμελούς δακτυλίου με ένα άτομο αζώτου και πέντε άτομα άνθρακα.
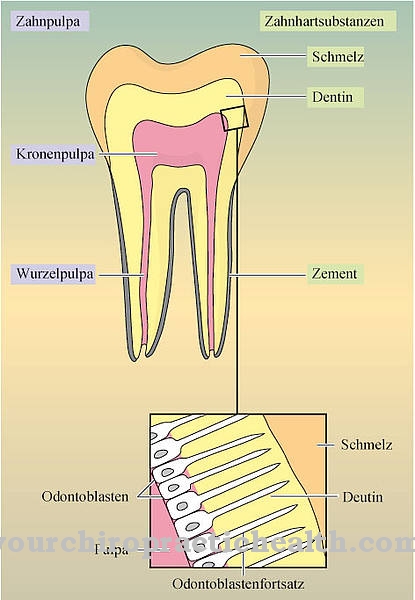
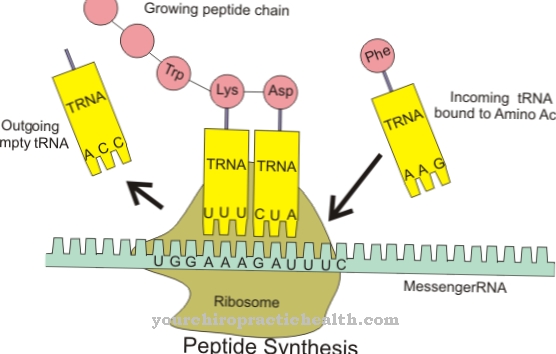
Χάρη στον κεντρικό δακτύλιο πυριδινίου, η δεσμοσίνη μπορεί να δικτυώσει τους μεμονωμένους κλώνους πρωτεΐνης στην ελαστική πρωτεΐνη ινών. Η σύνθεση της ελαστίνης είναι παρόμοια με αυτή του κολλαγόνου. Ωστόσο, αντί της υδροξυλυσίνης, η ελαστίνη έχει σημαντικό ποσοστό βαλίνης. Τα υπολείμματα λυσίνης οξειδώνονται σε αλυσίνη από το ένζυμο λυσυλοξειδάση. Τρεις αλυσίνες και μία λυσίνη με τη σειρά τους σχηματίζουν δεσμοσίνη με τη μορφή δακτυλίου. Αυτό το σχήμα παίζει σημαντικό ρόλο στην ελαστικότητα ενός ολόκληρου μορίου ελαστίνης.
Ως δίκτυο πρωτεϊνών, η ελαστίνη αποτελείται από μονάδες που συνδέονται με δεσμοσίνη και είναι ελαστικά ελαστική. Οι πνεύμονες, καθώς και το δέρμα και τα αιμοφόρα αγγεία εξαρτώνται από την ελαστίνη και τη συστατική της δεσμοσίνη, καθώς αυτός είναι ο μόνος τρόπος για να αποκτήσουν τη σημαντική ελαστικότητά τους. Η Δεσμοσίνη φθορίζει στο μπλε κάτω από το υπεριώδες φως και δίνει στην ελαστίνη το κίτρινο χρώμα της, την αδιαλυτότητά της στο νερό, τη θερμική σταθερότητα και την αντοχή στα αλκάλια και τις πρωτεάσες.
Εκπαίδευση, εμφάνιση, ιδιότητες και βέλτιστες τιμές
Ο σχηματισμός δεσμοσίνης είναι επίσης γνωστός ως βιοσύνθεση δεσμοσίνης. Κατά τη διάρκεια αυτής της βιοσύνθεσης, οι τερματικές αμινομάδες των μονάδων L-λυσίνης μετατρέπονται σε ω-αλδεϋδες από το ένζυμο λυσυλοξειδάση μέσω οξείδωσης.
Η λυσυλ οξειδάση είναι μια πρωτεΐνη οξειδάση 6 λυσίνης και αντιστοιχεί έτσι σε ένα ένζυμο που εμφανίζεται στον εξωκυτταρικό χώρο του συνδετικού ιστού. Στην διασταύρωση της ελαστίνης και του κολλαγόνου, χρησιμεύει ως καταλύτης και μηχανικός σταθεροποιητής πρωτεϊνών. Κατά τη διάρκεια της βιοσύνθεσης της δεσμοσίνης, η λυσυλοξειδάση μετατρέπει τη λυσίνη σε αλυσίνη. Αυτή η διαδικασία λαμβάνει χώρα στην εξωκυτταρική μήτρα και σταθεροποιεί τους διασταυρούμενους δεσμούς μεταξύ κολλαγόνου και ελαστίνης. Από χημική άποψη, η αντίδραση αντιστοιχεί σε οξειδωτική αποαμίνωση για να σχηματίσει την αλδεϋδη. Η αλλυσίνη σχηματίζει είτε αλλυσιναλδόλη είτε δεσμοσίνη με υπολείμματα αλδεΰδης γειτονικών μορίων τροπελαστίνης μέσω συμπύκνωσης αλδόλης.
Η υπολειπόμενη λυσίνη σχηματίζει μια βάση Schiff μέσω της αμινομάδας της και δημιουργεί ισοδεσμοσίνη. Εκτός από τα αιμοφόρα αγγεία, τους πνεύμονες και το δέρμα, όλα τα μικροϊνίδια ειδικότερα φέρουν δεσμοσίνη. Αυτές είναι οι μικρότερες ίνες κολλαγόνου, δικτυωτού και ελαστικού ιστού.
Ασθένειες & Διαταραχές
Ο σχηματισμός ελαστίνης από συστατικά όπως η δεσμοσίνη διακόπτεται σε διάφορες ασθένειες. Αυτές οι ασθένειες περιλαμβάνουν κυρίως μεταλλάξεις στο γονίδιο ELN. Οι πιο σημαντικές από αυτές είναι η δερματοχαλάση, το σύνδρομο Williams-Beuren και η υπογλώσσια συγγενής στένωση της αορτής. Η δερματοχαλάση είναι μια ομάδα αλλαγών του συνδετικού ιστού με οικογενειακή συσσώρευση.
Χαρακτηριστικό αυτής της ομάδας είναι το χαλασμένο, λιγότερο ελαστικό και ζαρωμένο δέρμα σε διάφορα μέρη του σώματος. Το γονίδιο ELN κωδικοποιεί την ελαστίνη και μπορεί να προκαλέσει τέτοια συμπτώματα μέσω μετάλλαξης. Το σύνδρομο Williams-Beuren είναι μάλλον σπάνιο σε σύγκριση με αυτό, επηρεάζοντας μόνο ένα στα 20.000 νεογέννητα. Η ασθένεια προκαλείται από ένα ελάττωμα στο χρωμόσωμα επτά. Ο γονιδιακός τόπος είναι 7q11.23. Λόγω ελαττώματος σε αυτό το σημείο, το προσβεβλημένο άτομο δεν έχει το γονίδιο ελαστίνης και τα γειτονικά γονίδια. Η διαγραφή του γονιδίου της ελαστίνης προκαλεί δυσμορφισμό του προσώπου και διαταραχές στη δομή του εσωτερικού οργάνου. Μπορεί να προκύψουν καρδιακά ελαττώματα, όπως στένωση της υπεραγγειακής αορτής και δυσπλασίες των νεφρών, όπως νεφρική πέταλο ή νεφρική αγγειακή στένωση. Επιπλέον, υπάρχει συχνά μια γνωστική αναπηρία.
Οι ψυχικές ικανότητες όσων επηρεάζονται είναι κάτω του μέσου όρου. Παρά τη λεκτική εκφραστικότητα, σχηματίζουν κυρίως προτάσεις με μικρό περιεχόμενο. Αρχίζουν να διαβάζουν σε πολύ μικρή ηλικία, κάτι που συχνά υπερεκτιμά τις ψυχικές τους ικανότητες. Εκτός από την υπερλεξία τους, το τέλειο βήμα τους οδηγεί συχνά σε υπερεκτιμήσεις. Ως μορφή μετάλλαξης ελαστίνης, η υποαγγειακή συγγενής στένωση της αορτής αντιστοιχεί με τη σειρά της σε δυσπλασία της καρδιάς που σχετίζεται με στένωση της κύριας αρτηρίας. Η υπερσυσκευή στένωση βρίσκεται πάνω από την αορτική βαλβίδα στην αρχή της αορτής.
Αυτή η μορφή του καρδιακού ελαττώματος χαρακτηρίζεται συχνά από περιορισμούς σε σχήμα κλεψύδρας που βρίσκονται πάνω από την έξοδο των στεφανιαίων αγγείων. Το ανερχόμενο τμήμα της αορτής μπορεί επίσης να μειωθεί. Αυτή η μορφή στένωσης αορτής εμφανίζεται ιδιαίτερα συχνά στο πλαίσιο του συνδρόμου Williams-Beuren που μόλις συζητήθηκε. Αυτό το καρδιακό ελάττωμα έχει ήδη παρατηρηθεί ανεξάρτητα από την ασθένεια. Σε αυτήν την περίπτωση, ωστόσο, δεν πρέπει απαραίτητα να σχετίζεται με μια μετάλλαξη στο γονίδιο ελαστίνης.







.jpg)